10. Januar 2020
Neue Funktion für potenziellen Tumor-Suppressor in der Gehirnentwicklung
Analyse des Cdkn1c-Verlusts auf Einzelzellebene zeigt neue und unerwartete Rolle des Gens – Studie erschien in Nature Communications
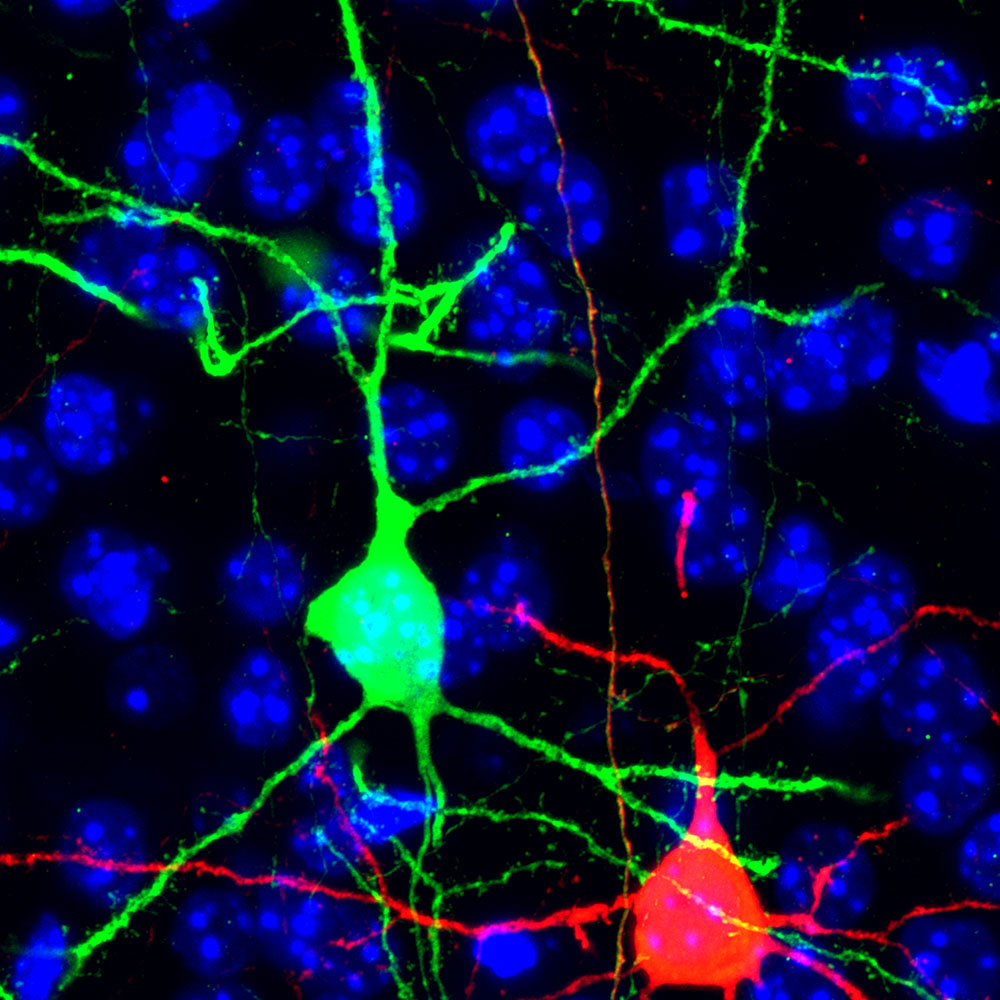
Das Gen Cdkn1c hätte als klarer Fall betrachtet werden können: Mäuse, bei denen das Gen entfernt wurde, sind größer und haben größere Gehirne, Cdkn1c sollte also das Wachstum hemmen. Diese Beobachtung führte dazu, dass Cdkn1c als Tumorsuppressor-Gen untersucht wurde. Neue Forschung aus der Gruppe von Simon Hippenmeyer, Professor am Institute of Science and Technology Austria (IST Austria), hat nun eine neue, genau entgegengesetzte Rolle für Cdkn1c entdeckt. Wenn Cdkn1c nur in bestimmten Zellen des Gehirns entfernt wird, sterben diese Zellen. Das spricht für eine neue wachstumsfördernde Rolle von Cdkn1c. Die neue Forschung wird heute im Fachmagazin Nature Communications veröffentlicht.
Simon Hippenmeyer und seine Forschungsgruppe, darunter ErstautorInnen Susanne Laukoter (PhD Studentin), Robert Beattie (Postdoc) und Florian Pauler (Senior Technical Assistant), entfernten Cdkn1c in einer Gehirnregion, dem Kortex, von Mäusen – mit einem überraschenden Ergebnis: Im Gegensatz zu den bisherigen Annahmen war der Kortex kleiner, nicht größer, als bei Tieren mit einer normalen Menge an Cdkn1c. Um dieses scheinbare Paradoxon zu verstehen, verglichen die ForscherInnen die Auswirkung eines Cdkn1c-Verlustes im ganzen Tier mit dem Verlust des Gens in nur einem einzigen Gewebe oder sogar in einzelnen Zellen der sich entwickelnden Maus.
Untersuchung der Gehirnentwicklung und Genfunktion auf Einzelzellebene mit MADM
Mit Hilfe einer genetischen Technik namens Mosaic Analysis with Double Markers (MADM) konnten die ForscherInnen das Gen in einzelnen Zellen ausschalten und dabei gleichzeitig die Auswirkung der Gendeletion auf diese Zellen unter dem Mikroskop sichtbar machen. Als sie das Gen Cdkn1c in Zellen des gesamten Kortex entfernten, war der Kortex kleiner. „Wenn wir das Gen entfernen, sterben die Zellen. Tatsächlich sehen wir massiven Tod durch Apoptose”, erklärt Hippenmeyer.
In einem Kortex, in dem Cdkn1c entfernt wurde, modifizierten die ForscherInnen einzelne Zellen weiter mit MADM, um dann ihr Schicksal zu beobachten. Sie fanden heraus, dass eine Zelle, die zwei intakte Kopien von Cdkn1c besitzt, vor dem Tod geschützt ist. Besitzt eine Zelle allerdings nur eine intakte Kopie von Cdkn1c, stirbt die Zelle. Interessanterweise spielt es keine Rolle, ob die DNA, die „Gebrauchsanweisung” in unseren Zellen, die definiert, wie Produkte wie Proteine hergestellt werden, aktiv ist und damit die Bildung von Proteinen ermöglicht, oder nicht. Schon zwei Kopien der intakten DNA, der intakten Gebrauchsanweisung, reichen aus, um eine Zelle vor dem Tod zu beschützen.
Implikationen für Studien zu Hirnfehlbildungen und Tumorentwicklung
Für Hippenmeyer unterstreicht diese Studie, wie wichtig es ist, die Auswirkung eines Genverlusts sowohl auf der systemischen Ebene (d.h. des Genverlusts im gesamten Tier) als auch in einzelnen Zellen zu untersuchen. „Unsere Methode zeigt eine neue Funktion von Cdkn1c auf, denn das Entfernen des Gens in einer einzelnen Zelle hat eine grundlegend andere Wirkung als das Entfernen im ganzen Tier. Systemische Effekte könnten die in einzelnen Zellen beobachtete Wirkung überdecken. Es ist wichtig, dies auch bei menschlichen Krankheitsbildern zu untersuchen, die zu Fehlbildungen des Gehirns führen, wie z.B. Mikrozephalie.”
Da Cdkn1c und seine Rolle bei der Entstehung von Tumoren umfassend untersucht wird, haben die neuen Ergebnisse wahrscheinlich auch wichtige Auswirkungen auf diesem Gebiet, sagt Florian Pauler. „Das Interesse an Cdkn1c ist groß, da es als Tumorsuppressor angesehen wird. Wie die einzelnen Zellen und das einzelne Gewebe, die wir untersuchten, können auch Tumore als nicht-systemisch angesehen werden. Unsere Erkenntnisse verändern also die Art und Weise, wie wir über Cdkn1c denken sollten, auch bei Tumoren.”
Auch in Zukunft werden Hippenmeyer und seine Arbeitsgruppe die Mechanismen und Funktionen von Cdkn1c erforschen. „Wenn dieses Stück DNA fehlt, wird etwas Grundlegendes verändert und der Tod der Zelle ausgelöst. Natürlich wollen wir jetzt wissen, warum und wie das passiert”, versichert Hippenmeyer.
Publikation
Susanne Laukoter, Robert Beattie, Florian M. Pauler, Nicole Amberg, Keiichi I. Nakayama & Simon Hippenmeyer. 2020. Imprinted Cdkn1c genomic locus cell-autonomously promotes cell survival in cerebral cortex development.Nature Communications. DOI: 10.1038/s41467-019-14077-2
Fördermittel
Dieses Projekt wurde durch Mittel des Fonds zur Förderung der Wissenschaftlichen Forschung (FWF), des European Research Council unter dem Horizon 2020 Forschungs- und Innovationsprogramm der Europäischen Union (grant agreement no 725780) und der NÖ Forschung und Bildung n[f + b] (C13-002) ermöglicht.
Tierwohl
Um zu verstehen, wie das menschliche Gehirn Information abspeichert und verarbeitet, ist es unumgänglich das Gehirn von Tieren während bestimmter Verhaltensweisen zu untersuchen. Keine anderen Methoden, wie z. B. in vitro oder in silico-Modelle, stehen hierfür als Alternative zur Verfügung. Die Tiere wurden gemäß der strengen in Österreich geltenden gesetzlichen Richtlinien aufgezogen, gehalten und behandelt.



