12. März 2020
Proteine als molekulare Schalter
IST Austria-Biochemiker kommen Selbstorganisation von Rab-Proteinen auf die Spur – Studie erscheint in PNAS
© IST Austria – Loose Gruppe
Eine bislang unbeantwortet gebliebene Frage in der Erforschung der Zellteilung ist jene, wie sich spezielle Proteine namens Rab small GTPasen selbst organisieren. Nun wurde sie von Urban Bezeljak, PhD-Student in der Gruppe von Professor Martin Loose am Institute of Science and Technology Austria (IST Austria), zusammen mit theoretischen Biophysikern der National University of Singapore, in einer aktuellen Studie in Angriff genommen, die in den Proceedings of the National Academy of Sciences of the United States of America (PNAS) veröffentlicht wurde.
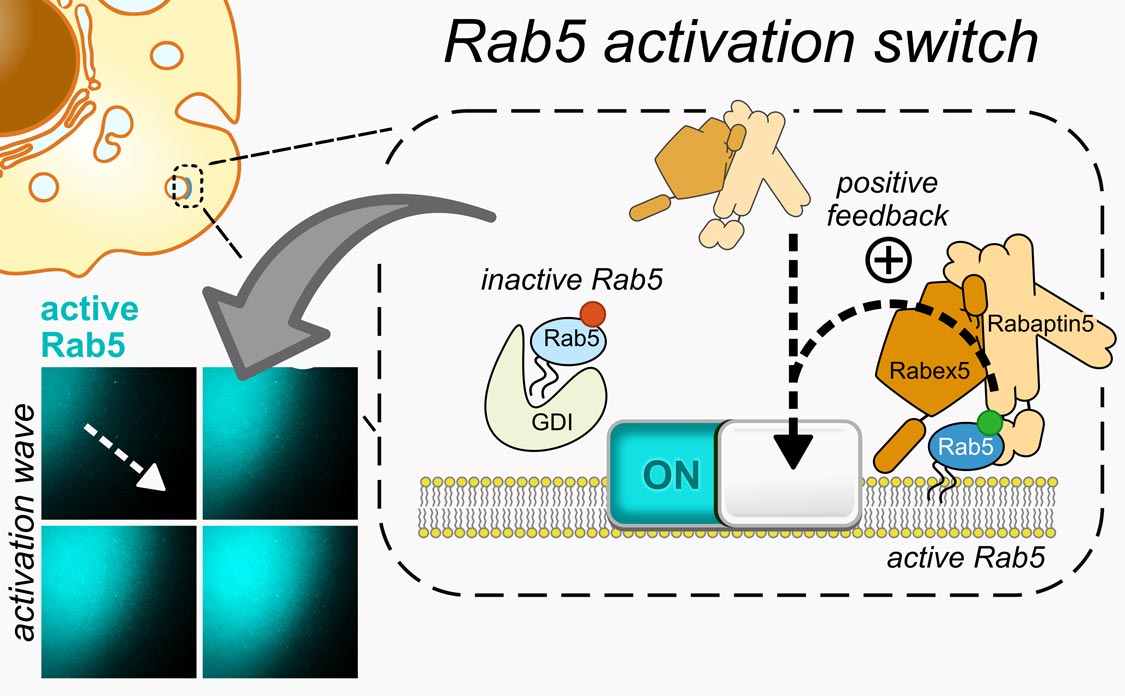
Rabs steuern die Bewegung verschiedener Komponenten in unseren Zellen. Die Forscher analysierten die Details dieses Prozesses, indem sie ihn im Labor nachahmten und die Dynamik fluoreszenzmarkierter Proteine unter dem Mikroskop beobachteten. Bezeljak: „Wir haben herausgefunden, dass Rabs wie molekulare Schalter funktionieren, die sich dank einer positiven Rückkoppelung im Zuge ihrer Aktivierung alle gleichzeitig einschalten. Durch diese einzigartige Funktion können Rabs den Membranverkehr koordinieren, der zur Einkapselung zellulärer Fracht notwendig ist.“
Zugehöriges Video auf YouTube ansehen
Biologische Membran (dunkel), an die sich das aktivierte fluoreszenzmarkierte Rab5 (cyan) in einem ausbreitenden wellenartigen Muster bindet. Dies geschieht, weil aktives und membrangebundenes Rab5 weitere fluoreszierende Proteine seiner Art aktivieren kann. Dies führt zu einem positiven Rückkoppelungseffekt und durch die Bewegung der Proteine entlang der 2D-Membran entsteht die beobachtete Aktivierungswelle.
© IST Austria – Loose Gruppe
Die Studie bietet neue Einblicke in kleine GTPase-Netzwerke, die unsere Zellen räumlich und zeitlich organisieren. Zudem führt sie einen einzigartigen Ansatz der Rekonstruierung molekularer Maschinerien ein, mit dem auch ähnliche Regelkreise untersucht werden können. Das Verständnis darüber, wie Proteine in unseren Zellen zusammenarbeiten und sich organisieren, ist besonders wichtig, da diese biochemischen Netzwerke bei Krebs, neurodegenerativen Erkrankungen und Infektionen auch fehlreguliert werden können.
Die Projektpartner aus der Gruppe von Timothy Saunders des Mechanobiology Institute an der National University of Singapore haben das Paper in diesem Artikel anschaulich zusammengefasst.
Über den Erstautor
Bevor Urban Bezeljak 2015 zum IST Austria kam, erwarb er seinen BSc und MSc in Biochemie an der Universität von Ljubljana, Slowenien. Dort beschäftigte er sich erstmalig mit synthetischer Biologie, forschte an der gerichteten Proteinassemblierung und entwarf genetische Netzwerke. Im Zuge seines PhD-Studiums in der der Loose Gruppe konnte Urban seine verschiedenen wissenschaftlichen Interessen vereinen. 2018 erhielt er ein Tuma-Stipendium für außergewöhnliche slowenische DoktorandInnenen in Österreich.

Urban Bezeljak, PhD-Student in der Loose Gruppe © IST Austri
Publikation
Bezeljak U, Loya H, Kaczmarek B, Saunders TE & Loose M. 2020. Stochastic activation and bistability in a Rab GTPase regulatory network. PNAS. DOI: 10.1073/pnas.1921027117
Förderinformation
Diese Arbeit wurde vom Human Frontier Science Program (HFSP RGY0083 / 2016) unterstützt.



